헤마글루티닌 (인플루엔자)
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
헤마글루티닌(HA)은 인플루엔자 A 바이러스(IAV)에서 발견되는 당단백질로, 바이러스의 아형을 결정하는 주요 요소 중 하나이다. HA는 최소 18개의 아형(H1~H18)으로 분류되며, 이 중 H1, H2, H3가 사람에게 주로 발견된다. HA는 바이러스가 숙주 세포에 침투하는 데 중요한 역할을 하며, 세포의 시알산 수용체에 결합하여 세포 내 섭취를 유도한다. HA는 중화 항체의 주요 표적이 되며, 머리 항체와 줄기 항체를 통해 바이러스 감염을 억제하는 데 기여한다. HA 줄기를 모방한 면역원은 보편적인 백신 개발에 활용될 수 있으며, 아비돌과 같은 다른 치료제 역시 HA를 표적으로 한다.
더 읽어볼만한 페이지
- 인플루엔자바이러스 A형 - H7N9
H7N9는 인플루엔자 A형 바이러스의 아형으로, 헤마글루티닌(H7)과 뉴라미니다제(N9) 단백질 종류에 따라 분류되며, 2013년 중국에서 처음 인체 감염 사례가 보고된 조류 인플루엔자 바이러스의 일종으로, 높은 변이율과 유전자 재조합 가능성으로 지속적인 감시와 연구가 필요하다. - 인플루엔자바이러스 A형 - H5N6
H5N6는 조류 인플루엔자 바이러스의 한 유형으로, 대한민국, 일본 등에서 발생하여 중국, 동남아시아 등에서 인체 감염 사례가 보고되었으며, 철새 이동, 가금류 불법 밀반입 등으로 전파되고, 급성 폐렴 증상을 보이며, 항바이러스제 투여가 치료법으로 제시되고, 개인 위생 관리와 가금류 접촉 회피가 예방책으로 권고되며, 대한민국 발생 당시 방역 실패와 살처분 방식에 대한 비판이 있었고, 지속적인 발생 가능성과 인체 감염 위험 증가에 대한 우려가 제기된다.
2. 아형 (Subtypes)
인플루엔자 A 바이러스(IAV)의 헤마글루티닌(HA)은 18가지 이상의 서로 다른 아형으로 분류된다.[7] 이 아형들은 H1부터 H18까지 이름이 붙여진다. H16은 2004년 스웨덴과 노르웨이에서 채취한 검은머리갈매기로부터 분리된 IAV에서 발견되었고, H17은 2012년 과일박쥐에서, H18은 2013년 페루 박쥐에서 각각 발견되었다.[8][9][10] H1, H2, H3는 인간에게서 발견되는 주요 아형이다.
HA 단백질은 계통수 유사성에 따라 2개의 그룹으로 나뉜다. H1, H2, H5, H6, H8, H9, H11, H12, H13, H16, H17, H18은 1군에 속하고 나머지는 2군에 속한다.[11]
IAV의 혈청형은 표면에 발현되는 HA와 뉴라미니다아제(NA) 단백질에 의해 결정된다.[12] 뉴라미니다아제는 11개의 알려진 아형을 가지고 있다. 따라서, 인플루엔자 바이러스는 HA와 NA 단백질의 조합에 따라 H1N1, H5N2와 같이 이름이 붙여진다.[7]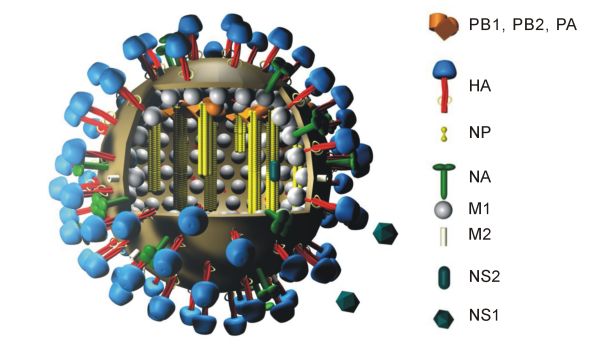
2. 1. 고병원성 조류 인플루엔자 (H5N1)
고병원성 조류 인플루엔자 A 바이러스(H5N1)는 원래 조류 숙주뿐만 아니라 인간도 감염시키는 것으로 알려져 있지만, 매우 드물게 발생한다.[1] 인간 환자에게서 발견된 바이러스의 H5 헤마글루티닌 단일 아미노산 변화는 "조류 H5N1 바이러스의 수용체 특이성을 크게 변경하여 인간 인플루엔자 바이러스에 최적화된 수용체에 결합할 수 있는 능력을 제공한다"고 보고되었다.[13][14] 이러한 발견은 일반적으로 인간을 감염시키지 않는 H5N1 바이러스가 어떻게 돌연변이를 일으켜 인간 세포를 효율적으로 감염시킬 수 있게 되는지 설명하는 것으로 보인다. H5N1 바이러스의 헤마글루티닌은 단백질 분해에 의해 활성 형태로 쉽게 전환되기 때문에 높은 수준의 병원성과 관련이 있는 것으로 보인다.[15][16]3. 구조 (Structure)
HA는 호모트리머(homotrimer) 통합 막 단백질 당단백질이다. C3 분자 대칭을 가지며, 원기둥 모양이고 길이는 약 13.5나노미터이다.[17][18] HA 삼량체는 세 개의 동일한 단량체로 구성되며, 각 단량체는 HA1 및 HA2 영역을 가진 온전한 HA0 단일 폴리펩타이드 사슬로 만들어지고 2개의 이황화 결합으로 연결된다.[18][19] 각 HA2 영역은 알파 나선 코일 코일 구조를 채택하고 HA1 영역 위에 위치하며, HA1은 α/β 구조가 혼합된 작은 구형 도메인이다.[20] HA 삼량체는 임의의 조기 및 원치 않는 융합 활성을 방지하기 위해 비활성 단백질 전구체 HA0으로 합성되며, 감염성을 갖기 위해서는 숙주 프로테아제에 의해 절단되어야 한다. 중성 pH에서 HA2의 N-말단 근처 23개의 잔기(바이러스와 숙주 막 사이의 융합을 담당하는 융합 펩타이드)는 HA2 삼량체 인터페이스 사이의 소수성 포켓에 숨겨져 있다.[21] HA2의 C-말단은 막관통 도메인으로도 알려져 있으며, 바이러스 막을 가로질러 막에 단백질을 고정시킨다.[22]
3. 1. HA1
HA1은 주로 역평행 베타 시트로 구성된다.[17]3. 2. HA2
HA2 도메인은 각 단량체에서 세 개의 긴 알파 나선을 포함한다. 각각의 나선은 루프-B(잔기 59~76)라고 하는 유연한 루프 영역으로 연결된다.[23]4. 기능 (Function)
HA는 바이러스 진입에 두 가지 주요 기능을 수행한다. 첫째, 표적 척추동물 세포를 인식할 수 있게 하는데, 이는 이 세포의 시알산 함유 수용체에 결합함으로써 이루어진다. 둘째, 일단 결합되면 숙주 내소체 막과 바이러스 막의 융합을 일으켜 바이러스 게놈이 표적 세포로 진입하는 것을 돕는다.[24]
구체적으로 단백질의 HA1 도메인은 표적 세포 표면에 존재하는 단당류 시알산에 결합하여 바이러스 입자가 숙주 세포 표면에 부착될 수 있도록 한다. HA17과 HA18은 시알산 대신 진입 수용체로 MHC class II 분자에 결합하는 것으로 설명되었다.[25] 그런 다음 숙주 세포 막이 바이러스를 삼키는데, 이를 세포 내 섭취라고 하며, 세포 내에서 새로운 막 결합 구획을 형성하기 위해 분리되어 내소체를 형성한다. 그런 다음 세포는 내부를 산성화하여 리소좀으로 변환하여 내소체 내용물을 소화하기 시작하려고 시도한다. 일단 내소체 내의 pH가 약 5.0~6.0으로 떨어지면 단백질에 일련의 형태 변화가 일어난다. 먼저, 융합 펩타이드가 소수성 포켓에서 방출되고 HA1이 HA2 도메인에서 분리된다. 그런 다음 HA2 도메인은 결국 두 막을 밀착시키는 광범위한 형태 변화를 겪는다.
pH가 낮아지면서 방출되는 이른바 "융합 펩타이드"는 분자 갈고리처럼 작용하여 내소체 막에 삽입되어 고정된다. 그런 다음 HA2는 새로운 구조로 다시 접히고(낮은 pH에서 더 안정적임), "갈고리를 철회"하여 내소체 막을 바이러스 입자 자체의 막 바로 옆으로 당겨 두 막이 함께 융합되도록 한다. 일단 이것이 일어나면 바이러스의 내용물(예: 바이러스 RNA)이 숙주 세포의 세포질로 방출된 다음 복제를 위해 숙주 세포 핵으로 운반된다.[26]
5. 치료 표적 (As a treatment target)
헤마글루티닌은 인플루엔자 A 바이러스의 주요 표면 단백질이자 바이러스가 세포 내로 침투하는데 필수적인 역할을 한다. 따라서 헤마글루티닌은 중화 항체의 주요 표적이 된다.[27] 이러한 항체는 헤마글루티닌의 이중 기능에 따라 두 가지 방식으로 작용한다. 일부 항체는 헤마글루티닌에 결합하여 바이러스가 세포에 부착하는 것을 억제하고, 다른 항체는 바이러스와 세포막의 융합을 막는다. 아비돌과 같이 헤마글루티닌을 표적으로 하는 항체가 아닌 다른 인플루엔자 바이러스 억제제도 존재한다.[37]
5. 1. 머리 항체 (Head antibodies)
일부 항체는 헤마글루티닌에 결합하여 부착을 억제한다. 이는 이러한 항체가 헤마글루티닌 "머리"(위 그림의 파란색 영역) 상단 근처에 결합하여 표적 세포의 시알산 수용체와의 상호 작용을 물리적으로 차단하기 때문이다.[27]5. 2. 줄기 항체 (Stem antibodies)
이 항체 그룹은 막 융합을 방지함으로써 작용한다(단, ''시험관 내''에서만).[28] HA(HA2)의 줄기 또는 자루 영역은 다양한 인플루엔자 바이러스 균주에서 매우 보존되어 있어, 광범위 중화 항체 및 보편적 백신 개발의 표적이 된다.[29] 이 영역을 표적으로 하는 항체는 막 융합 과정을 유도하는 주요 구조적 변화를 차단하여 여러 인플루엔자 바이러스 아형에 대해 항바이러스 활성을 달성할 수 있다.F10,[31] FI6,[32] CR6261[33][34] 등의 인간 항체가 이에 해당되며, 수용체 결합 부위에서 멀리 떨어진 줄기/자루 영역의 부위를 인식한다.
5. 2. 1. 줄기 항체 기반 백신 개발
항체 그룹은 막 융합을 방지함으로써 작용한다(''시험관 내''에서만; 이 항체의 ''생체 내'' 효능은 항체의존성 세포 독성 및 보체계의 결과로 여겨진다).[28]HA(HA2)의 줄기 또는 자루 영역은 다양한 인플루엔자 바이러스 균주에서 매우 보존되어 있다. 이러한 보존성은 모든 인플루엔자 아형을 표적으로 하는 광범위 중화 항체와 인간이 이러한 항체를 자연적으로 생성하도록 하는 보편적인 백신 개발에 매력적인 표적으로 만든다.[29] 전융합에서 후융합 형태로의 구조적 변화는 바이러스 막과 숙주 막 사이의 융합을 유도한다. 따라서 이 영역을 표적으로 하는 항체는 궁극적으로 막 융합 과정을 유도하는 주요 구조적 변화를 차단할 수 있으며, 따라서 여러 인플루엔자 바이러스 아형에 대해 항바이러스 활성을 달성할 수 있다. 적어도 하나의 융합 억제 항체가 헤마글루티닌의 상단에 더 가깝게 결합하는 것으로 밝혀졌으며, 머리를 함께 교차 결합하여 막 융합 과정의 첫 번째 단계로 여겨지는 머리 개방을 통해 작용하는 것으로 생각된다.[30]
인간 항체 F10,[31] FI6,[32] CR6261 등은 수용체 결합 부위에서 멀리 떨어진 줄기/자루 영역(오른쪽 그림의 주황색 영역)의 부위를 인식한다.[33][34]
2015년 연구원들은 항체 CR9114의 바이러스에 결합하는 부위를 구체적으로 HA 줄기를 모방한 면역원을 설계했다. 면역원을 투여받은 설치류 및 영장류가 아닌 모델은 H5N1을 포함한 여러 인플루엔자 아형에서 HA와 결합할 수 있는 항체를 생성했다.[35] HA 머리가 존재할 경우 면역계는 일반적으로 bNAb(광범위 중화 항체)를 생성하지 않는다. 대신, 소수의 아형만 인식하는 머리 항체를 생성한다. 머리가 세 개의 HA 단위를 함께 유지하는 역할을 하므로 줄기만 있는 HA는 자체적으로 유지할 수 있는 자체적인 방법이 필요하다. 한 팀은 HA를 함께 유지하기 위해 페리틴이라는 단백질을 사용하여 자가 조립 HA 줄기 나노 입자를 설계했다. 다른 팀은 적절한 머리가 없는 미니 HA를 안정화하기 위해 아미노산을 대체하고 추가했다.
2016년 인간 대상 백신 임상 시험에서 면역계가 생성한 줄기를 표적으로 하는 많은 광범위 중화 항체가 발견되었다. 여러 인간 지원자로부터 매우 유사한 세 가지 종류의 항체가 회수되어 재현 가능한 항체를 생성하는 보편적인 백신이 실제로 가능하다는 것을 시사했다.[36]
5. 3. 기타 치료제 (Other agents)
아비돌을 포함하여 헤마글루티닌을 표적으로 하는 항체가 아닌 다른 인플루엔자 바이러스 억제제도 있다.[37]- 아비돌
- 소분자
- 천연 화합물
- 단백질 및 펩타이드
참조
[1]
논문
Receptor binding and membrane fusion in virus entry: the influenza hemagglutinin
Annual Reviews
2000-07
[2]
논문
Virus membrane-fusion proteins: more than one way to make a hairpin
2006-01
[3]
논문
Structure of influenza hemagglutinin in complex with an inhibitor of membrane fusion
2008-11
[4]
논문
Entry of influenza A virus: host factors and antiviral targets
2014-02
[5]
논문
High-content analysis of sequential events during the early phase of influenza A virus infection
2013-07-12
[6]
서적
Lehninger's Principles of Biochemistry
WH Freeman
[7]
웹사이트
Types of Influenza Viruses
https://www.cdc.gov/[...]
2023-03-30
[8]
논문
Characterization of a novel influenza A virus hemagglutinin subtype (H16) obtained from black-headed gulls
2005-03
[9]
웹사이트
Unique new flu virus found in bats
http://www.nhs.uk/ne[...]
[10]
논문
New world bats harbor diverse influenza A viruses
2013-10
[11]
논문
Protective efficacy of influenza group 2 hemagglutinin stem-fragment immunogen vaccines
2017-12-15
[12]
웹사이트
Influenza Type A Viruses
https://www.cdc.gov/[...]
CDC
2017-04-19
[13]
논문
Sialobiology of influenza: molecular mechanism of host range variation of influenza viruses
2005-03
[14]
논문
Evolution of the receptor binding phenotype of influenza A (H5) viruses
2006-01
[15]
논문
Molecular basis for high virulence of Hong Kong H5N1 influenza A viruses
2001-09
[16]
논문
Survey of the hemagglutinin (HA) cleavage site sequence of H5 and H7 avian influenza viruses: amino acid sequence at the HA cleavage site as a marker of pathogenicity potential
[17]
논문
Structure of the haemagglutinin membrane glycoprotein of influenza virus at 3 A resolution
1981-01
[18]
논문
Hemagglutinin-Mediated Membrane Fusion: A Biophysical Perspective
https://pure.rug.nl/[...]
2018-05
[19]
논문
Modulation of the pH Stability of Influenza Virus Hemagglutinin: A Host Cell Adaptation Strategy
2016-06
[20]
서적
Protein Reviews
Springer Singapore
2016
[21]
논문
The structure and function of the hemagglutinin membrane glycoprotein of influenza virus
1987-06
[22]
서적
Viruses and human disease
Elsevier / Academic Press
2008
[23]
논문
Structure of the uncleaved human H1 hemagglutinin from the extinct 1918 influenza virus
2004-03
[24]
서적
Structural Biology of Viruses
https://archive.org/[...]
Oxford University Press
[25]
논문
MHC class II proteins mediate cross-species entry of bat influenza viruses
2019-03
[26]
논문
Receptor binding and pH stability – how influenza A virus hemagglutinin affects host-specific virus infection
2014-04
[27]
논문
Molecular mechanisms of inhibition of influenza by surfactant protein D revealed by large-scale molecular dynamics simulation
2013-11
[28]
논문
Broadly neutralizing hemagglutinin stalk-specific antibodies require FcγR interactions for protection against influenza virus in vivo
2014-02
[29]
논문
Towards a universal influenza vaccine: different approaches for one goal
2018-01
[30]
논문
An antibody that prevents the hemagglutinin low pH fusogenic transition
2002-03
[31]
논문
Structural and functional bases for broad-spectrum neutralization of avian and human influenza A viruses
2009-03
[32]
논문
A neutralizing antibody selected from plasma cells that binds to group 1 and group 2 influenza A hemagglutinins
2011-08
[33]
논문
Heterosubtypic neutralizing monoclonal antibodies cross-protective against H5N1 and H1N1 recovered from human IgM+ memory B cells
[34]
논문
Antibody recognition of a highly conserved influenza virus epitope
2009-04
[35]
웹사이트
Universal flu vaccine: research moves closer
http://www.zmescienc[...]
2015-08-25
[36]
논문
Vaccine-Induced Antibodies that Neutralize Group 1 and Group 2 Influenza A Viruses
2016-07
[37]
논문
Investigational hemagglutinin-targeted influenza virus inhibitors
2017-01
[38]
웹사이트
Scientists race to develop a vaccine against a killer flu
http://www.mcclatchy[...]
2007-05-24
[39]
웹사이트
Bird flu: Don't fly into a panic – Harvard Health
https://www.health.h[...]
2006-10
[40]
저널
Structure of influenza hemagglutinin in complex with an inhibitor of membrane fusion
2008-11
[41]
저널
Entry of influenza A virus: host factors and antiviral targets
https://www.zora.uzh[...]
2014-02
[42]
저널
High-Content Analysis of Sequential Events during the Early Phase of Influenza A Virus Infection
2013-07-12
[43]
서적
Lehninger's Principles of Biochemistry
WH Freeman
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com
